9 生物医学光学成像
重点:
荧光显微成像
激光共聚焦扫描显微成像
多光子荧光扫描显微成像
二/三次谐波扫描显微成像
光学相干层析成像OCT
STORM/PALM, STED, SIM
各种能级图
成像原理
利用生物体某些光学特性的时空变化来获取光学图像
优点
- 不会产生辐射伤害
- 应用尺度广
- 利用透射散射反射,实现多维成像
- 监控化学和动力学变化
- 选择性好、精密度高、灵敏度大
9.1 普通显微成像
单透镜成像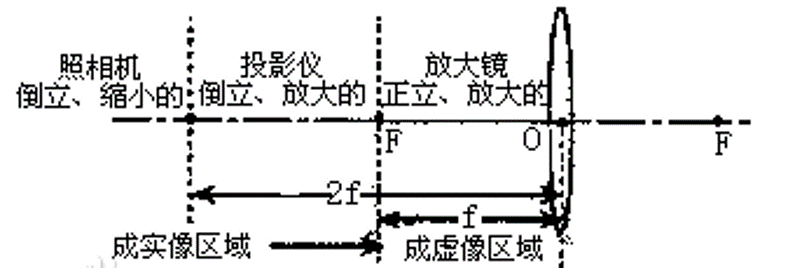
\(\frac{1}{u}+\frac{1}{v}=\frac{1}{f}\),放大倍数=\(\frac{v}{u}\)
科勒照明(4f)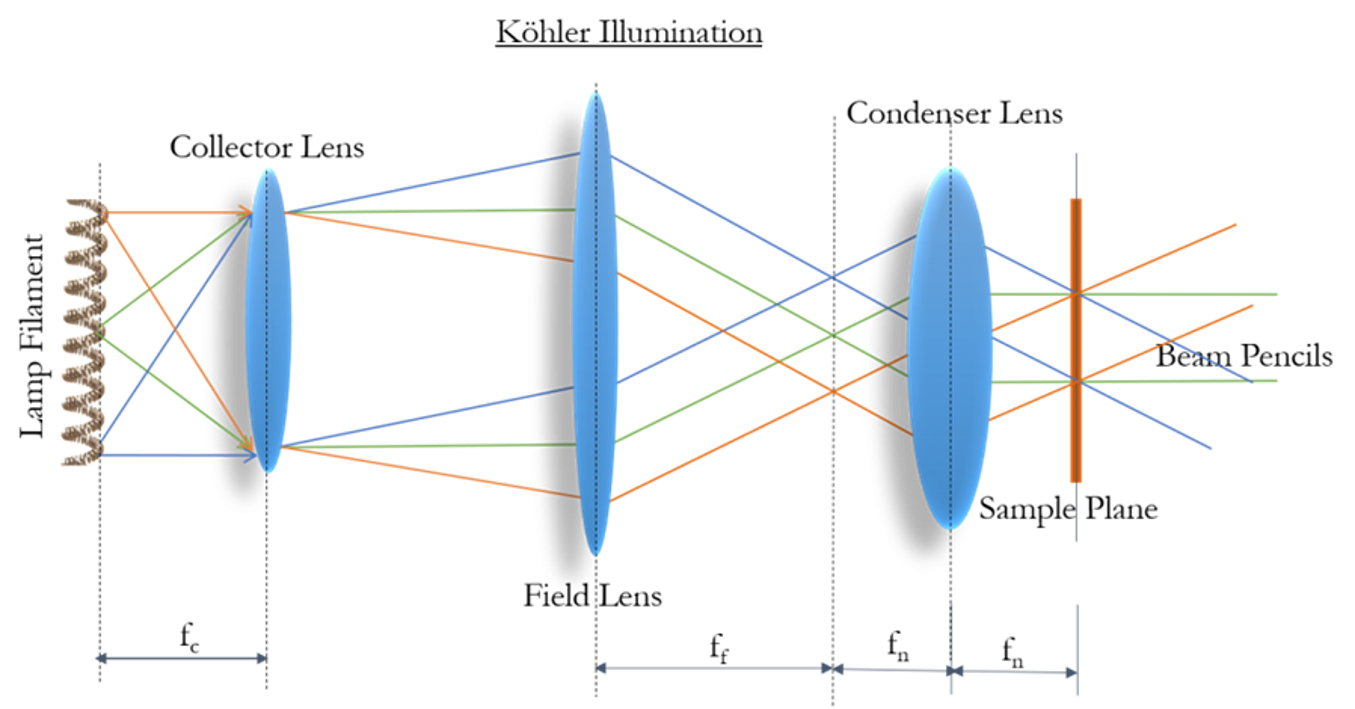
通过焦点的设置,使不均匀光源能够均匀照射样本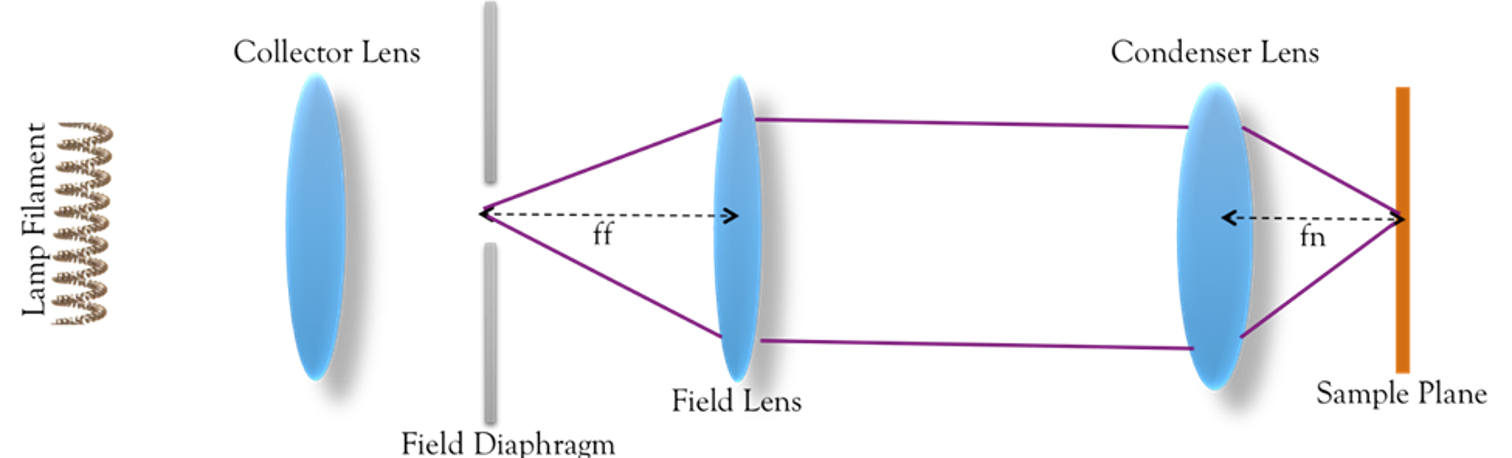
在收集透镜后放场光阑,达到调整视场的目的(调整样本被照亮的区域)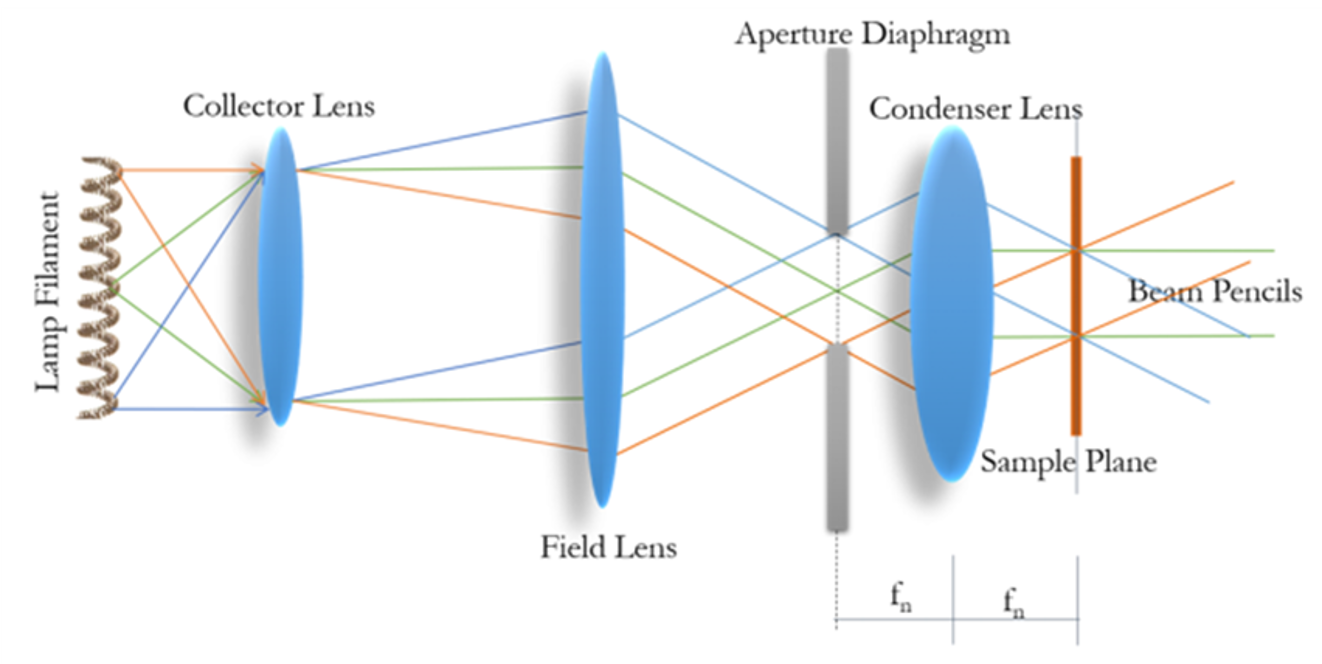
在场透镜后放孔径光阑,达到调整入角度的目的
分辨率
见6.3
提高分辨率最佳的形式是提高物镜的n,用油或者水
暗场显微成像
即成像的背景是暗的,适用于高透明度样本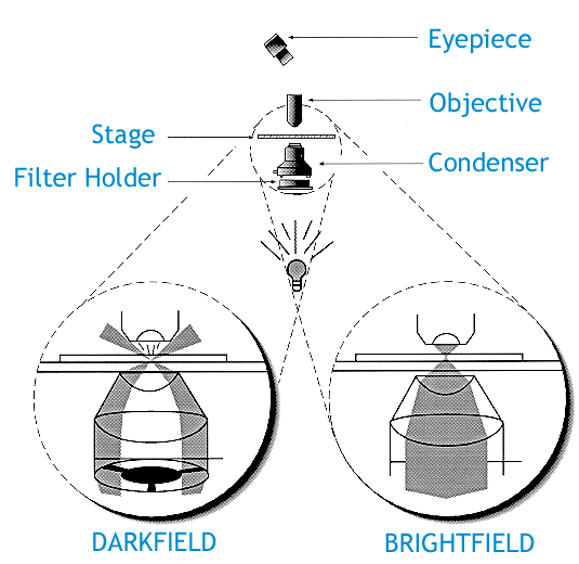
暗场显微镜使用挡光板,产生中空的锥形光,背景是暗的,成像时物镜仅仅收集到来自样品对照明光的散射信号
限制:图像亮度低
相衬显微成像
利用光透射产生的光程差成像,主要用于透明样本等光强变化小的情况
微分干涉显微成像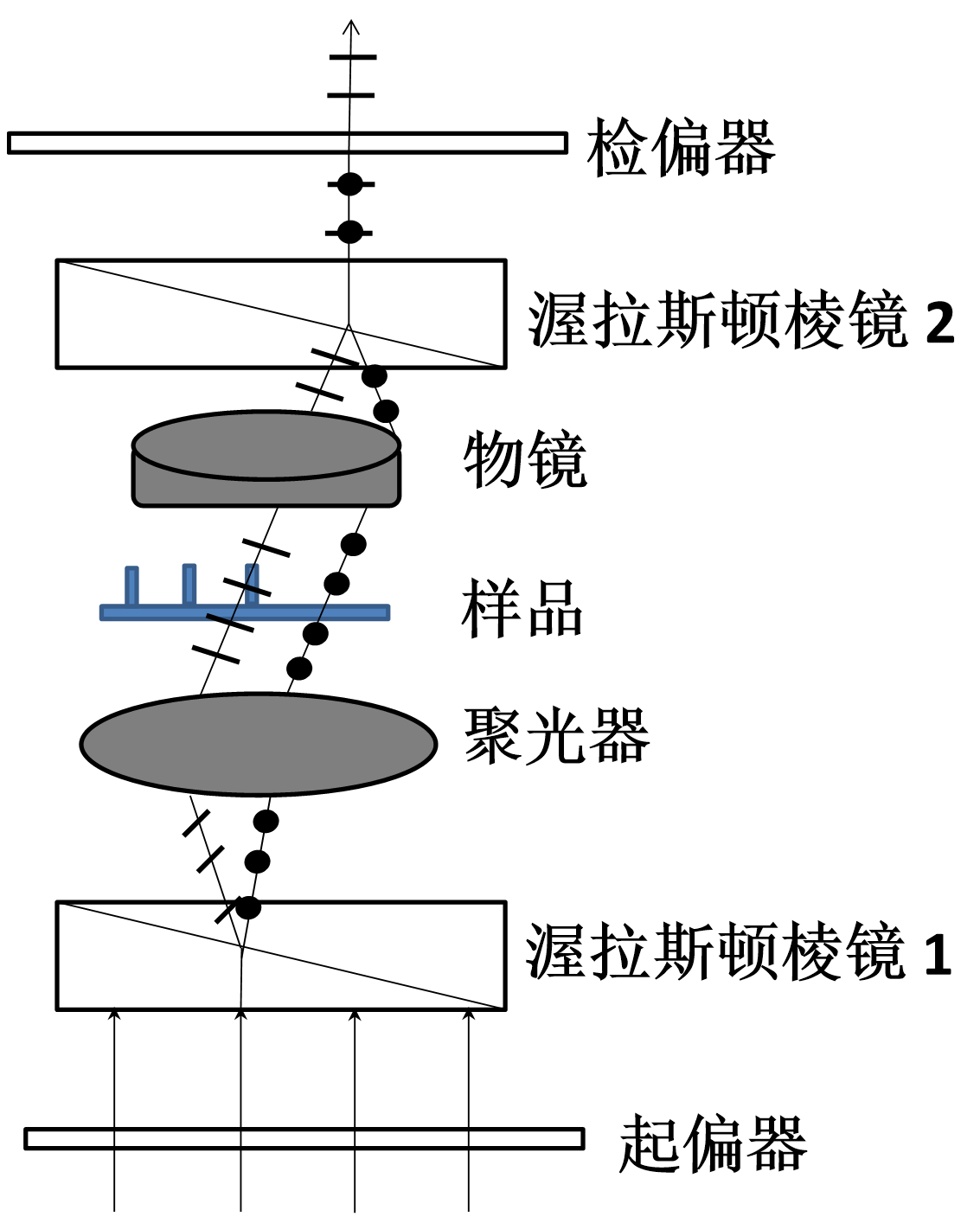
成像步骤
- 先得到线偏振光,利用棱镜分出s光和p光
- 透射样品
- 将s光和p光叠加干涉,得到图像
比相衬成像的图像质量高伪影少
最终是利用光程差的微分成像,图像有浮雕感
落射荧光显微成像
利用短波激发光激发长波荧光成像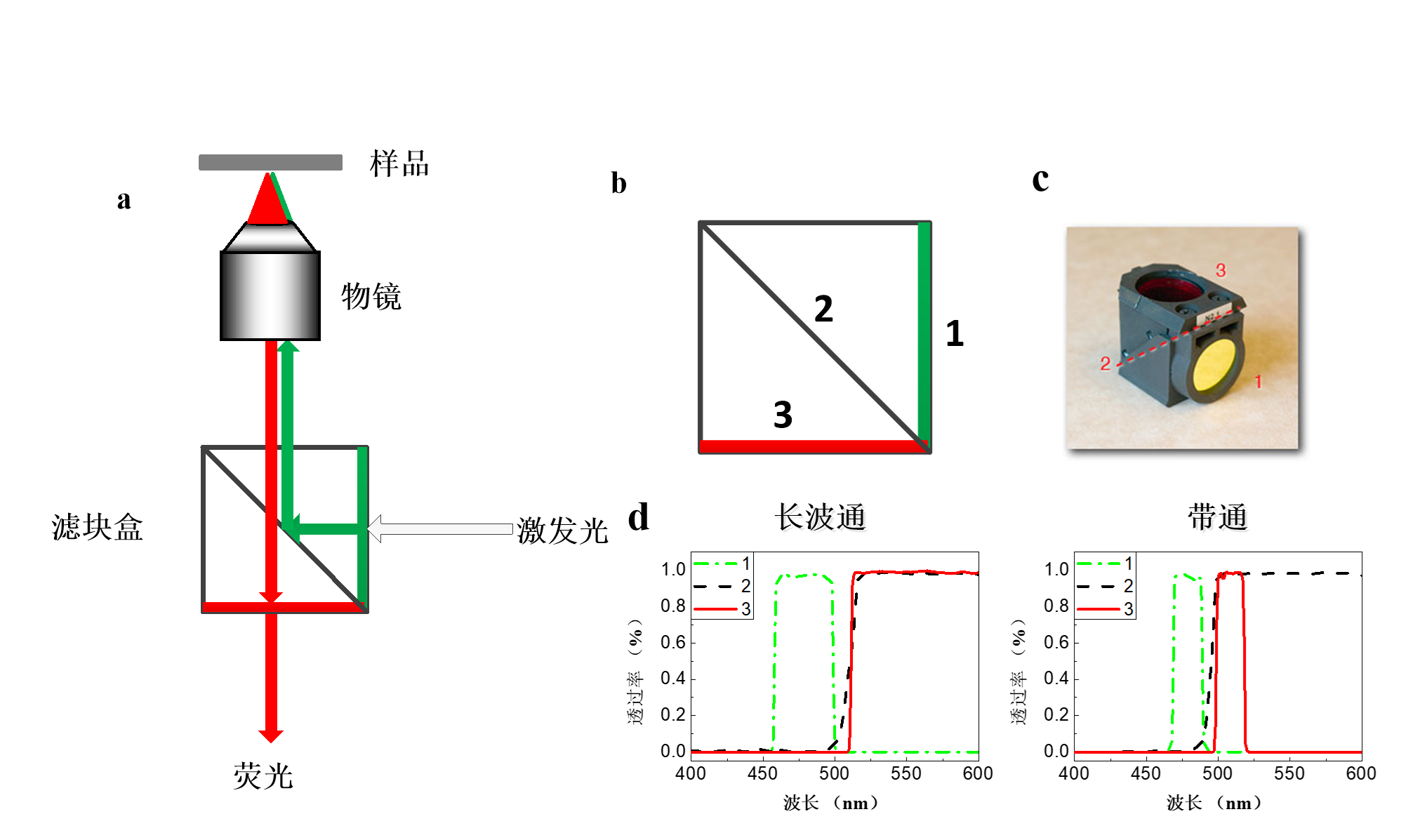
使用同一个物镜,滤光盒是一个长波通滤波器(低通),从右到左是:激发滤光片,二向色镜,发射滤光片
观察前需要用探针修饰
缺点
不能分层,荧光多层堆叠,平面的分辨率低,深度分辨率低;光漂白强(荧光消失快)
9.2 激光显微成像
全内反射荧光显微成像
利用全反射时产生的倏逝波对样品进行激发
倏逝波穿透力弱,约100~200nm,因此只有界面处约100nm的荧光信号被激发
是研究细胞膜表面问题的手段
光漂白降低,分辨率提高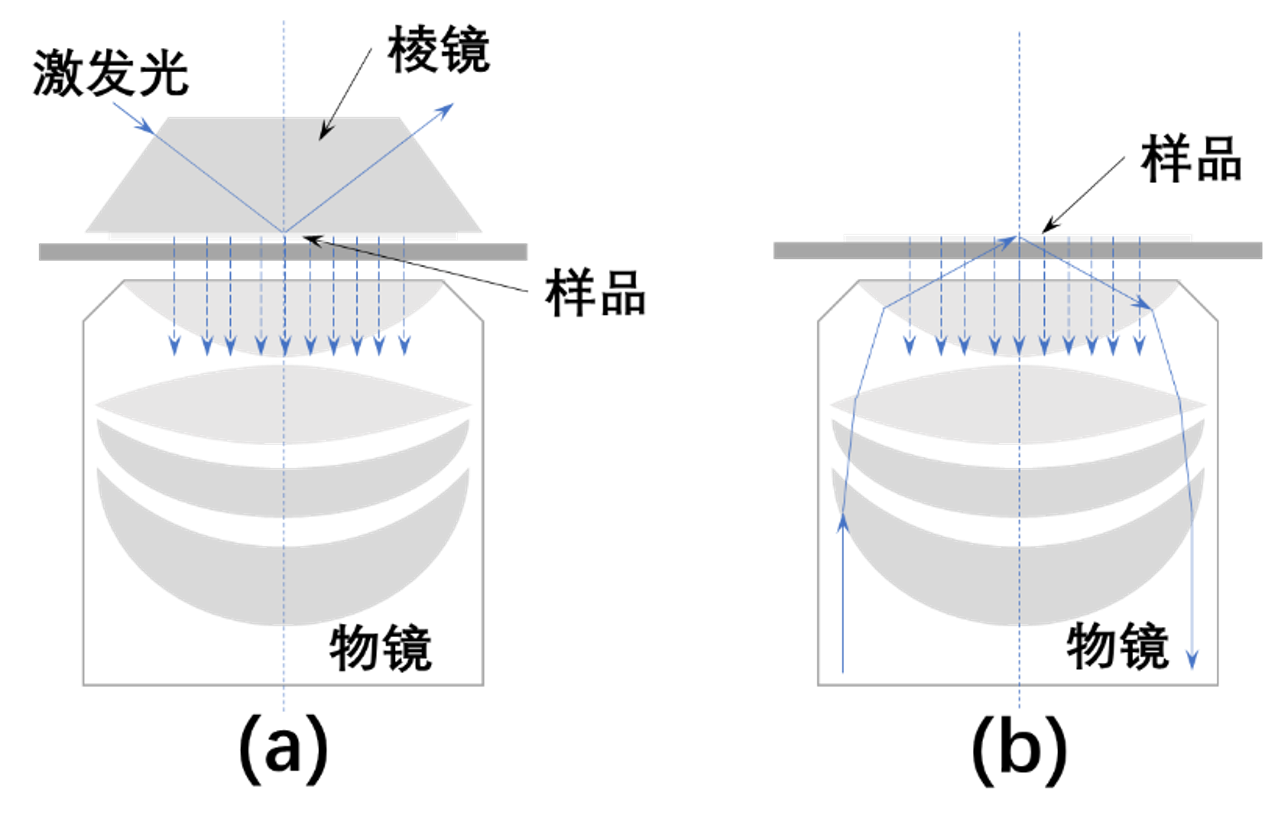
光片照明显微镜
激发光通过柱面镜产生光片,物镜位于光片的侧面,样品旋转,产生荧光,得到切片图像,进行重构
优点
光漂白降低,分辨率提高,成像速度快,允许多色成像
缺点
样品制备复杂,受限于物镜的大小,样品很小,无法进行活体成像
激光共聚焦扫描显微成像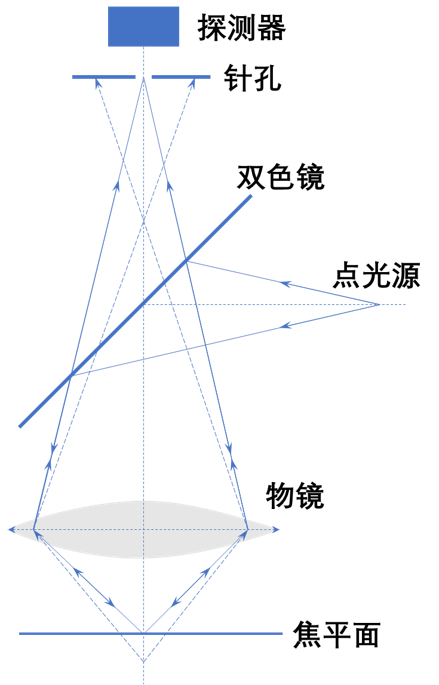
每次扫描一个点的信息;点光源、物点、针孔成共轭关系
焦点以外的信息被小孔挡住,减小焦点信息的干扰,空间分辨率高
探测器是光电倍增管(PMT),获取光强信息,没有分布信息
通过移动物镜来改变成像点
| 针孔尺寸 | 增大 | 变小 |
|---|---|---|
| 图像分辨率 | 低 | 高 |
| 纵向光学切片 | 厚 | 薄 |
| 图像亮度 | 亮 | 暗 |
缺点
- 扫描深度不足(<80um)
- 光漂白严重,几乎整个Z轴都受光
- 不能产生紫外荧光(激发光的波长更短,对生物有害)
- 空间分辨率收到衍射极限限制
FRET
Fluorescence Resonance Energy Transfer
当两种荧光满足下图时,会发生荧光能量转移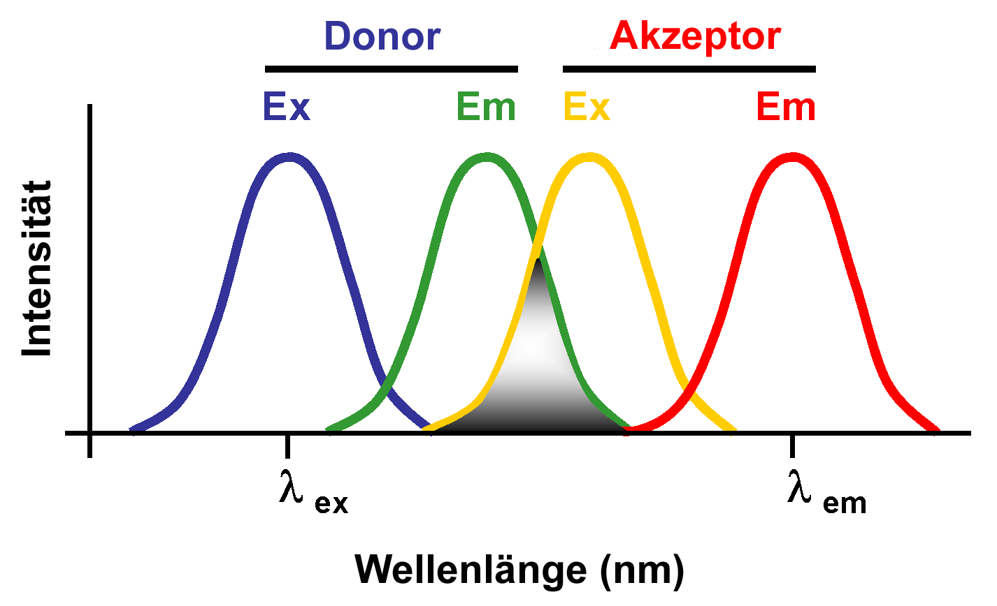
转移的荧光强度满足:\(I_A=I_D\cdot \frac{1}{R^6}\)
故只有当两种探针相距很近时才能探测
可以判断结合是否成功
FLIM
Fluorescence Lifetime Imaging Microscopy
荧光寿命在不同环境中不同,利用荧光寿命的变化感知环境的变化
例如,肿瘤在酸性微环境中,而在酸性环境中荧光寿命很短
与FRET互补
9.3 非线性光学显微成像
多光子激发荧光显微成像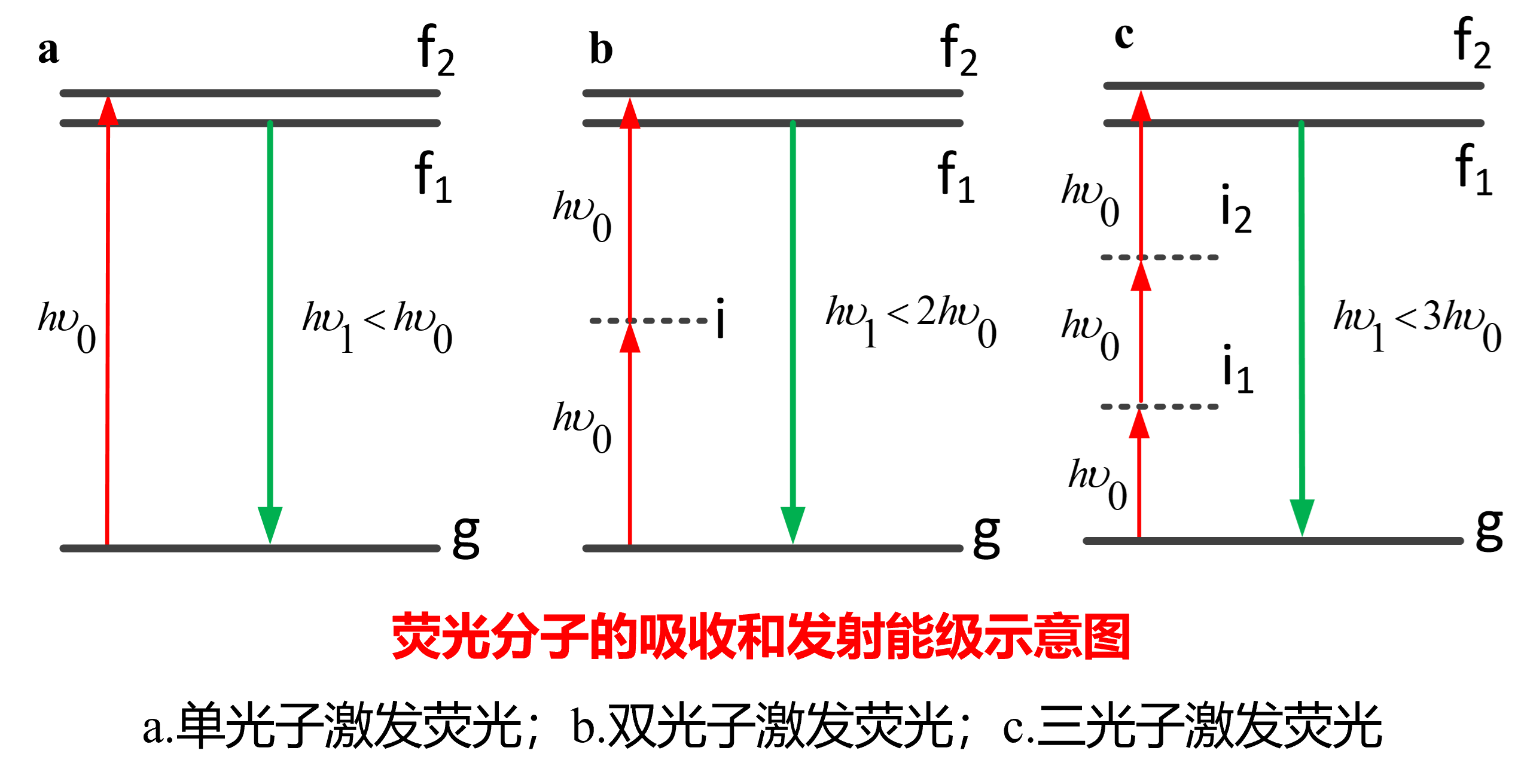
注意,多光子过程存在光子的吸收和释放,存在能量损耗
多光子与单光子的区别仅在吸收能量的过程,发出荧光的过程是一致的
三光子激发产生的荧光信号比双光子弱得多
吸收多光子的几率是吸收单光子几率的亿分之一
故需要能够在瞬间将光子集中发生的设备(高峰值功率,短脉冲+高NA物镜)
n光子激发,则激发光的强度与荧光的强度关系为\(I_{out}\propto I_{in}^n\)
飞秒激光器
\(1秒=10^{15}飞秒\)
可激发纯紫外染料
双光子扫描显微镜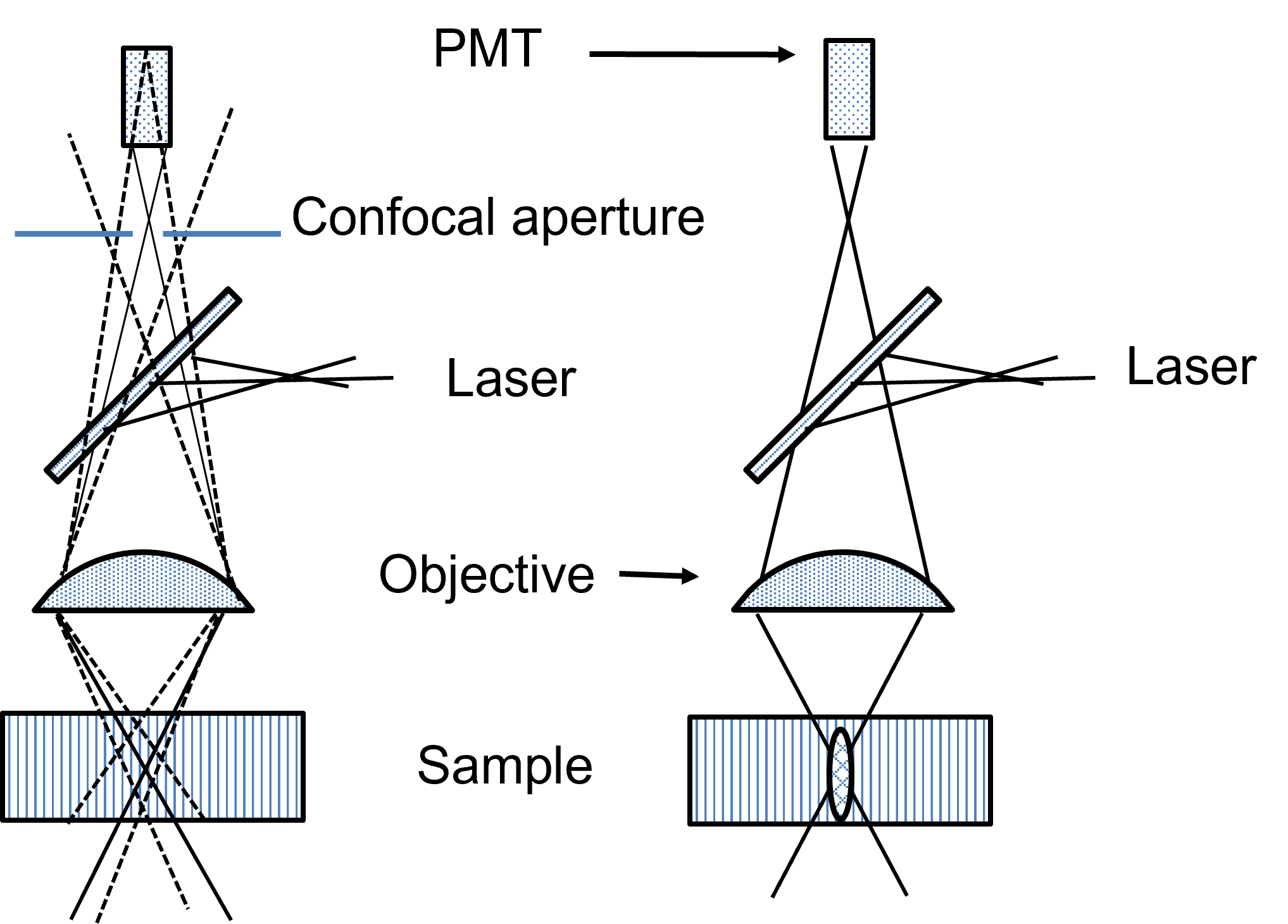
左边是共聚焦,右边是双光子,不需要针孔
由于多光子激发的概率极低,只有焦点除得到激发,故不需要针孔去阻挡除
显著特点
- 扫描深度深(300~800um)
- 高光子密度只在焦点处,其他可以忽略
故焦点外光损伤小,激光刺激和漂白也只在焦点位置 - 可以激发纯紫外染料,生物损伤小
满足\(\lambda_{单光子}<\lambda_{双光子}<2\lambda_{单光子}\)时能够激发荧光 - 和荧光的波长差距大,易于分离激发光和荧光
二/三次谐波扫描显微成像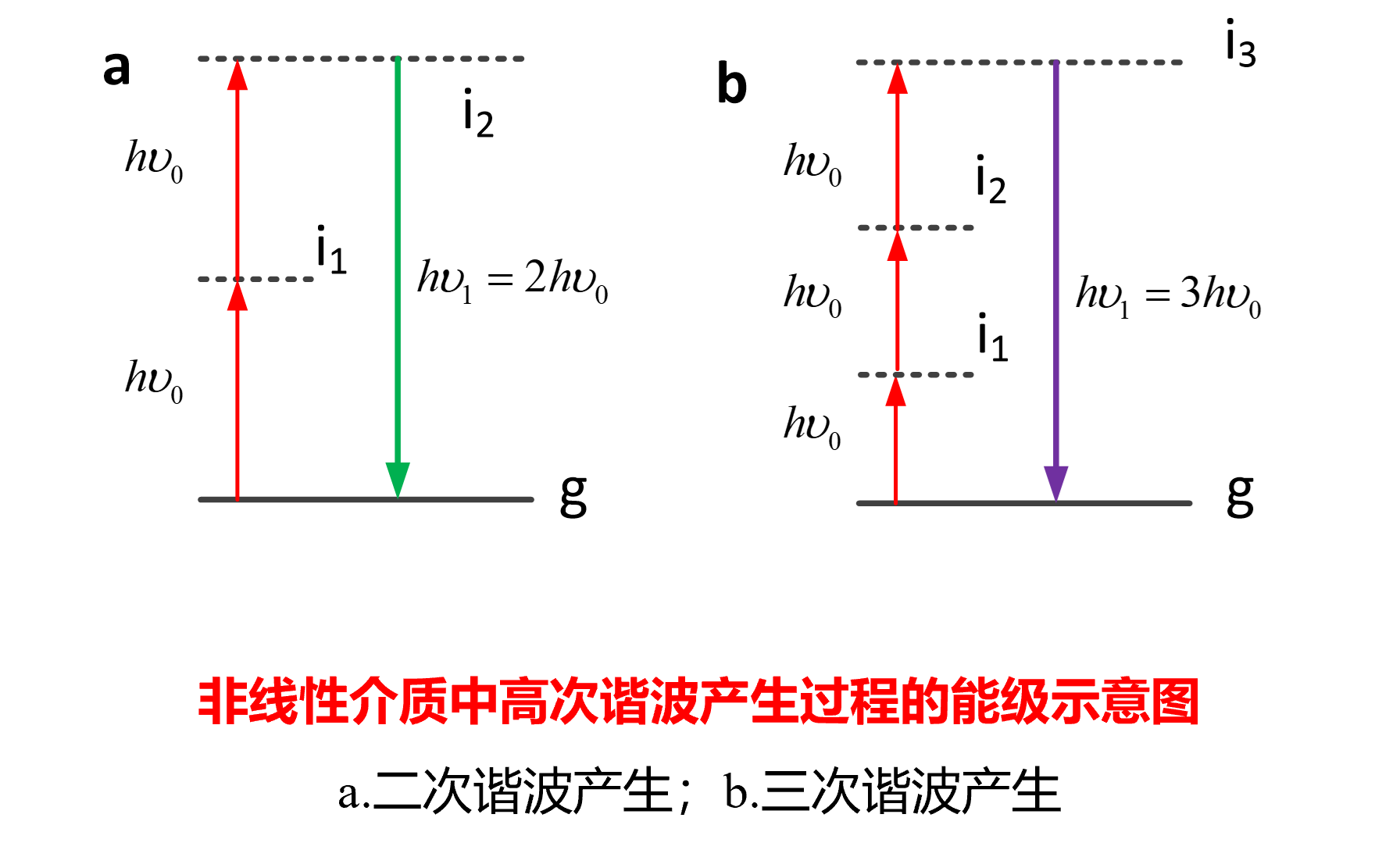
注意这个图中的能级不是实线,是虚能级
与多光子的区别
- 不涉及能级变化,即没有光子的吸收和释放,没有热损失
- 二次谐波生成只发生在非中心对称介质的界面
- 二次谐波信号的波长是泵浦激光波长的一半(多光子没有数值关系,必须实验测定)
- 可以用于非荧光、无标记的样品
相同点:非线性激发,无需针孔
二次和三次的区别
- 二阶非线性效应和三阶非线性效应
- 二次谐波生成只能发生在非中心对称介质,三次任意
二次三次的对比可以找出病变组织 - 波长分别是泵浦源的二/三分之一
相同点:没有光子吸收,不用针孔,前向探测居多,可以用于非荧光、无标记样品
受激拉曼SRS/相干反斯托克斯成像CARS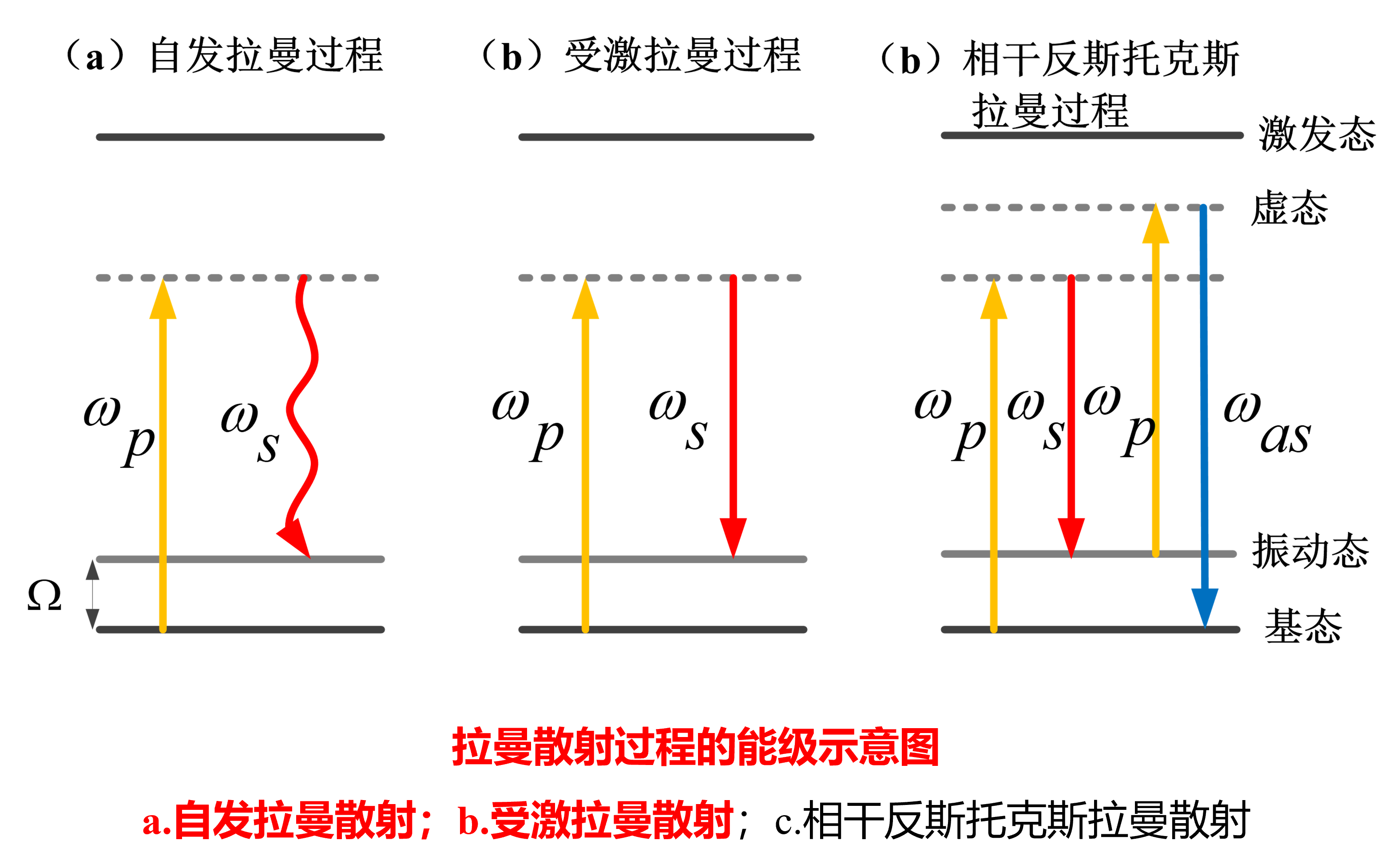
自发拉曼:提供p,发射s,概率低,强度弱
受激拉曼:提供p和s,发射s,概率高,强度大
CARS
无需荧光标记;信号波长短,无荧光干扰;信号强,成像快
SRS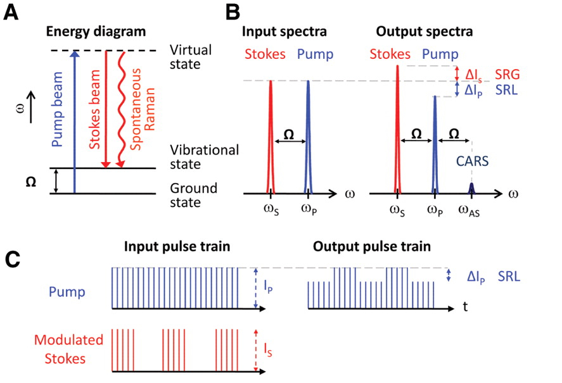
发射p和s,其中p是泵浦,s产生受激辐射
通过信号中的\(\Delta I_s和\Delta I_p\)来获取样品信息
注意到s不是连续的,pOutput和sInput是有关的
比CARS的优势:与样品浓度成线性关系;提供无背景且易于解释的化学对比
9.4 层析成像
B超
利用声波再不同组织界面发生反射折射等,获取不同层面的信息
用光信号代替声波?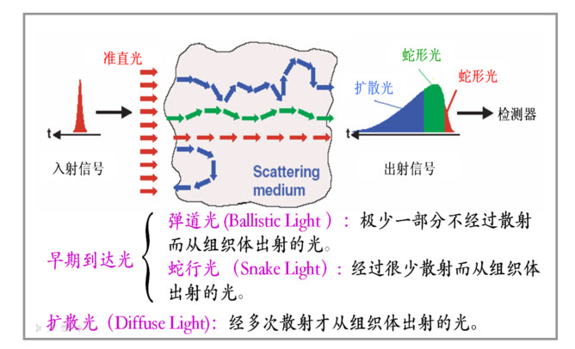
困难
时域上无法区分,脉冲相隔时间短(3.3fs)
有效光信号弱,弹道光太少了(红色是弹道光,打错字了)
光学相干层析成像(OCT)
是对眼睛成像的唯一手段
弱相干成像原理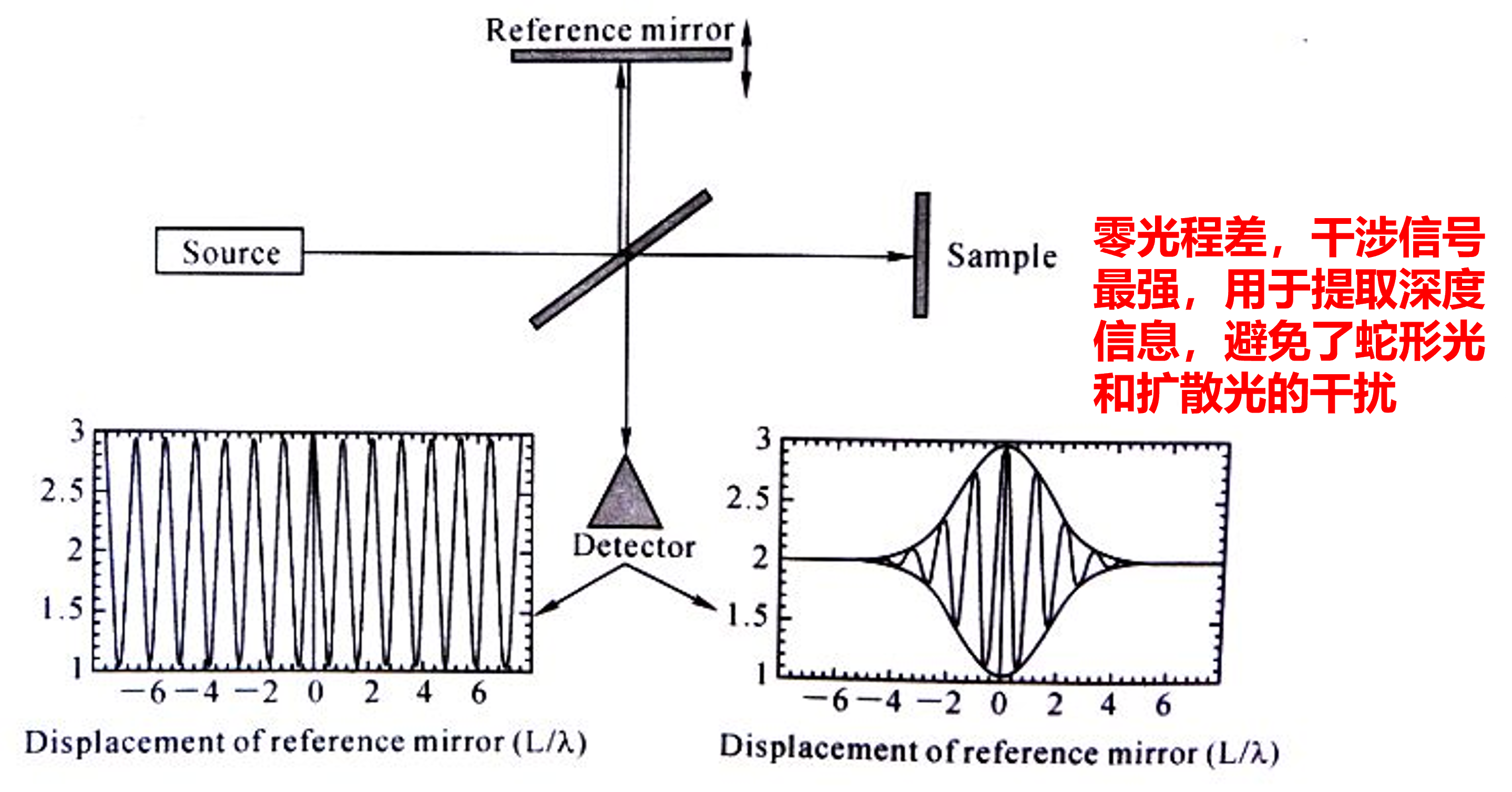
左边的是相干性好,相干长度长的光的干涉图像,右边是相反的图像
相干性弱的光干涉后的相干长度短,且干涉信号集中在零光程差处
反应了深度(z轴)的信息,避免蛇形光和扩散光干扰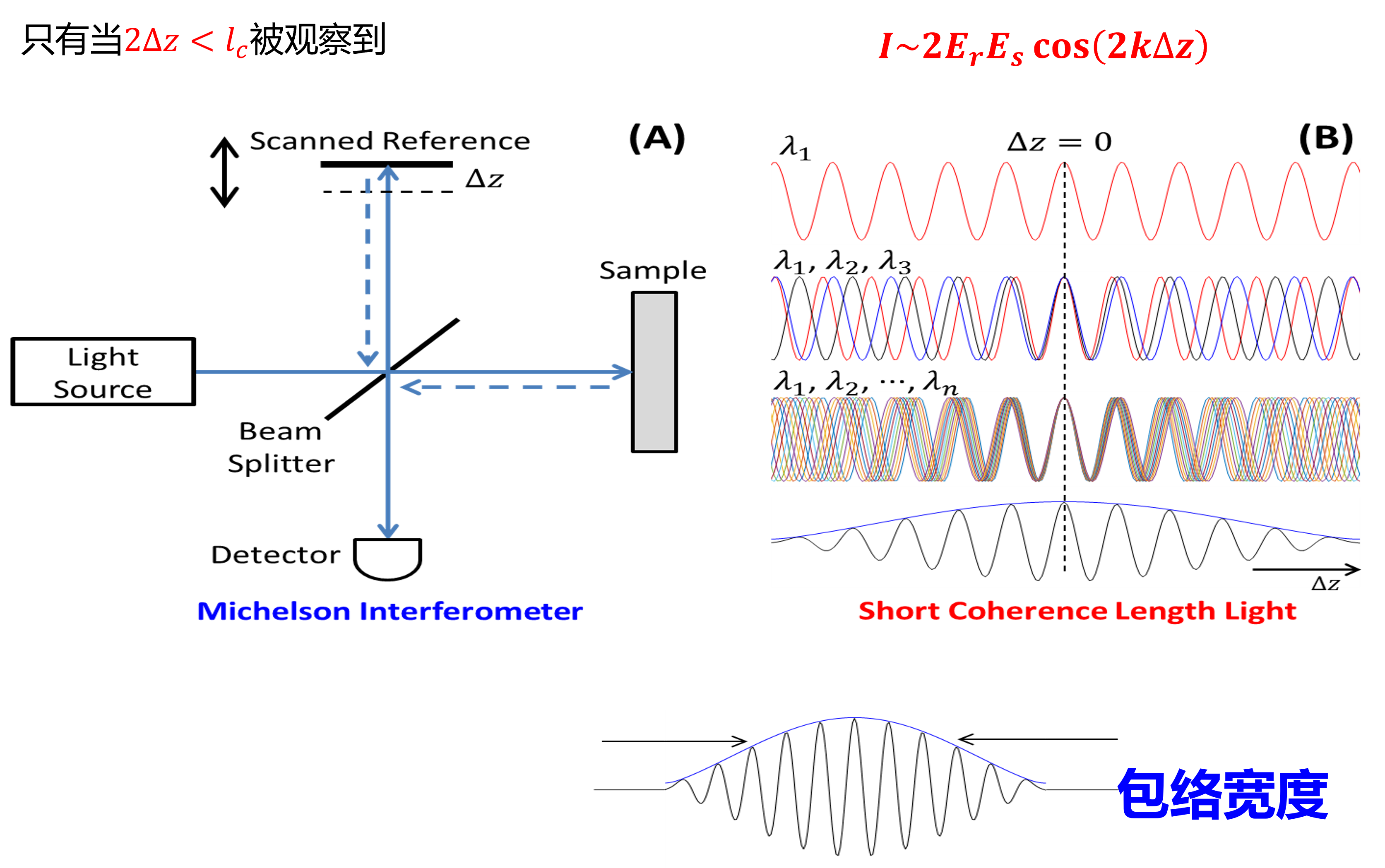
其中\(l_c\)是相干长度(包络长度),只有当\(2\Delta z
\(l_c=\frac{4\ln{2}}{\pi}\cdot\frac{\lambda_0^2}{\Delta\lambda}\),其中\(\Delta\lambda\)是光强下降到\(e^{-1}\)时的波长,\(\lambda_0\)是中心波长
带宽更宽的光谱,\(l_c\)更小,分辨率更高
包络的强度反映光强分布(即一层图像),包络的传递时间反映成像深度
OCT的分辨率
横向和纵向分辨率是独立的
纵向分辨率\(\delta z=\frac{l_c}{2}\),横向分辨率由物镜焦距和光斑尺寸决定,\(\Delta x=\frac{4\lambda}{\pi}\cdot\frac{f}{d}\)
故即使没有严格的聚焦,OCT依然有精确的纵向分辨率
OCT的成像过程任然是依靠干涉光强信息,上面是提高分辨率的方法
OCT光源
- 生物组织吸收少
- 生物组织散射小
- 横向纵向分辨率高
- 功率高
- 价格低。。。
频域OCT
时域OCT依靠改变\(\Delta z\)来改变干涉光强,频域OCT依靠改变\(k\)来改变干涉光强
\(I\sim 2E_rE_s\cos{(2k\Delta z)}\),是一个正弦波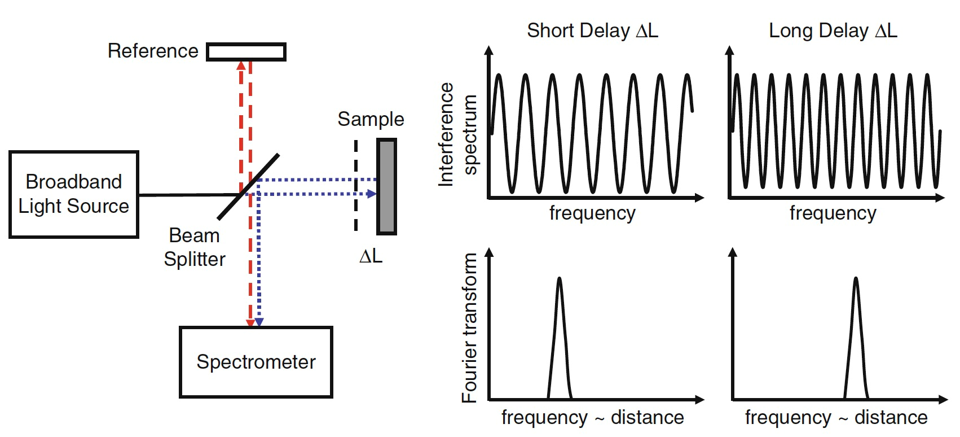
可见改变\(\Delta L\)对光谱的影响,对其做傅里叶变换得到频域上的冲击波形
\(\Delta L\)影响\(\omega\),在频域上分开了z轴
由于傅里叶变换的线性性,可以同时对不同层面成像,得到的是离散的冲击波形,成像很快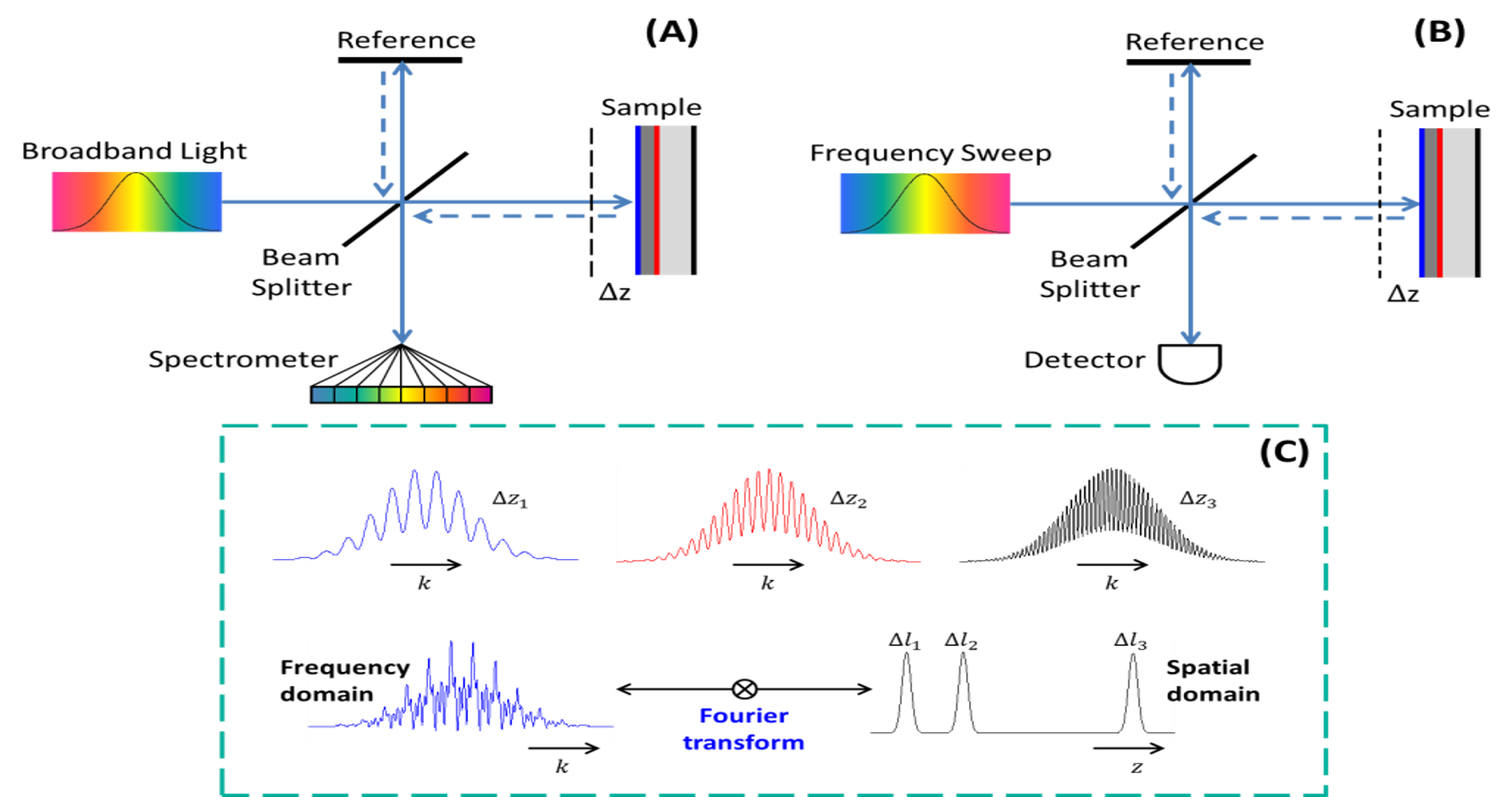
几种不同的OCT
OCT特点
- 空间分辨率:高,横向纵向独立
- 成像深度:比显微系统深很多
- 成像时间:短,可以动态化成像
- 临床适用性:损伤小,于内窥镜和导管结合
- 对冠状动脉,眼睛,神经等成像,避免切除性活检的伤害
光学成像和超声成像的对比
- 对比度:光学高
- 深度和分辨率:成像深度大时,光学质量低(z轴分辨率低)
光学成像的分斌率随深度增加而变差
光声层析成像(PAT)
用激光打击组织,组织产热,发生振动,产生声波(在体式流式细胞仪)
特点是光学对比度高,声学分辨率、深度高
避免了光散射的影响,间距光学和超声成像的优点
缺点:无法做层析,对图像的判断、分析需要很大的经验,发光信号弱时成像速度慢
在成像时必须选择目标组织会特异性吸收的波长的光,否则信噪比很高
光声效应
短脉冲激光经过扩束,照射生物样本,组织快速吸收能量发热,周围组织热胀冷缩产生热弹效应,产生压力波(超声波)
活体成像的衰减曲线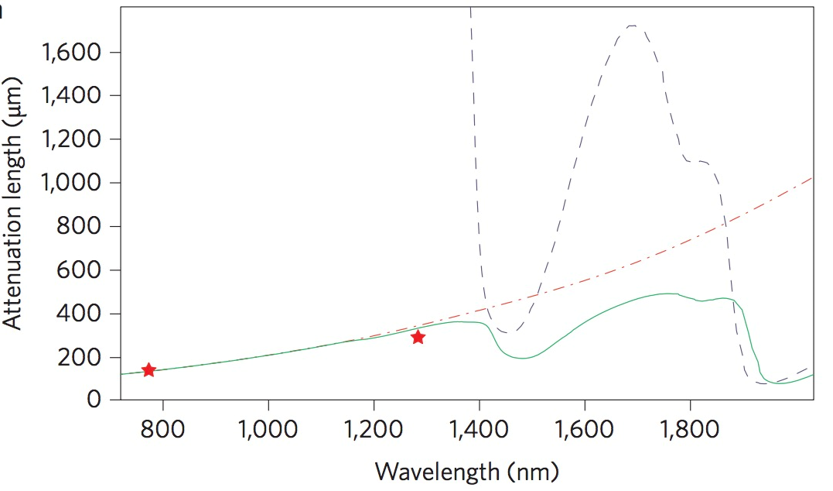
绿色的是衰减曲线,一般PAT使用1700nm左右的波长的光
9.5 远场超分辨显微成像
光学成像的限制始终是衍射极限
将点光源经过光学系统成像的光强分布用点扩散函数表示,实际上就是光学系统的单位冲激响应PSF(x,y)
和激励卷积得到任意响应
受激辐射耗尽显微成像(STED)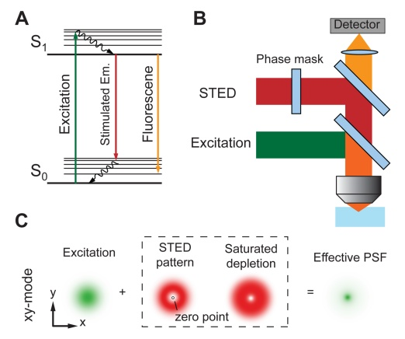
绿光是激励,红光是擦除光(空心的圆)
绿光将荧光物质泵浦到高能级,红光会使高能级物质受激辐射
在红光的空心区域,高能级荧光物质不会受激辐射,而是正常跃迁发出荧光
由于荧光的波长(很宽,是带)和受激辐射的波长(单一)不同,使用滤波器将红光过滤就得到了很细的荧光
绿光是铅笔,红光是橡皮擦
但是这依然无法避免衍射
使用PMT作为Detector,不记录分布,只记录一个点的光强
擦除的过程具体而言
是擦除光的光强很大,使受激辐射强于自发辐射(荧光)
在激励和擦除光的交集处,受激辐射占主导
擦除光的形状由涡旋相位滤片得到
最大分辨率\(\Delta x=\frac{\lambda}{2n\sin{\alpha}\sqrt{1+I_{max}/I_{sat}}}\)
其中Imax是擦除光的光强极大值,Isat是荧光分子饱和激发光强
提高Imax可以提高分辨率
STED光(擦除光)可以是高峰值功率的脉冲光,也可以是高功率的连续光
前者的平均功率低,对样品的热损伤小;后者更简单,便宜
光激活定位显微技术(PALM)
既然衍射极限是两个光点的像重合,那么一开始就只成一个像就好了
成像过程是:
在分辨率极限范围内让两个荧光分子分别单独发光
对单个光斑做高斯拟合,取中心点作为荧光分子的实际位置
当前一个荧光分子完全漂白后照亮下一个
各个荧光分子拼接到一张图上
缺点:
荧光分子激活、漂白时间长,成像速度慢
荧光分子漂白后无法再激活,一次性
无法持续成像
随机光学重构显微技术(STORM)
使用光开关控制荧光分子是否发出荧光
类似于PLAM
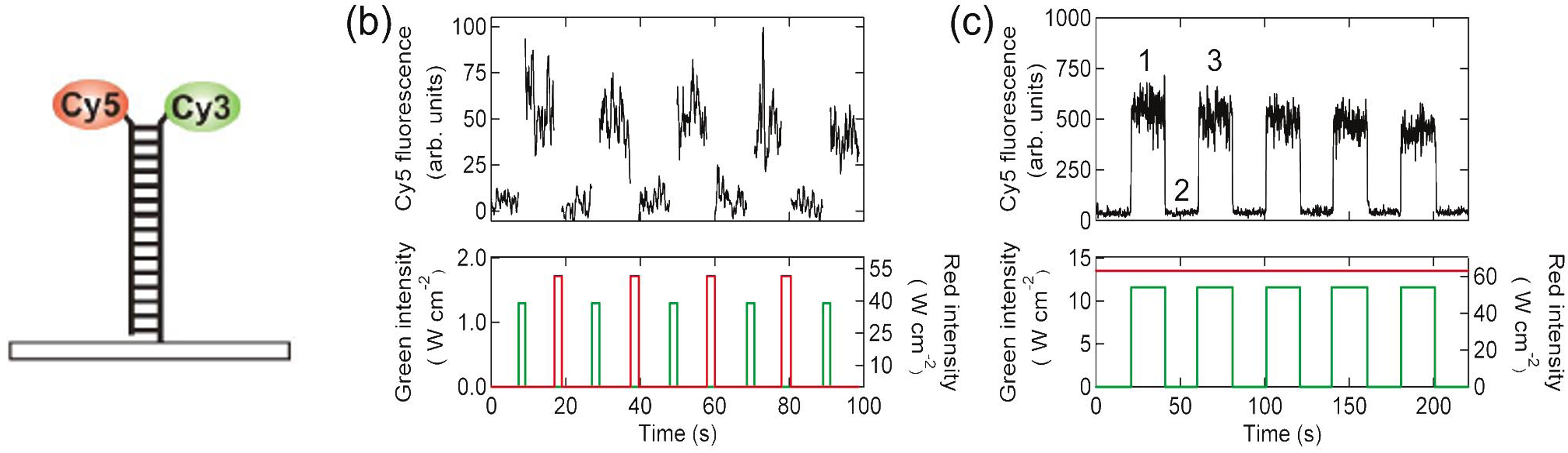
下面的绿光,红光仅代表对应的蛋白的光,而非光的波长
其中绿色的是光开关
当受到绿光照射时开关持续打开,此时照射微弱的红光可以使荧光蛋白发出荧光
若照射很强的红光则会使已经打开的开关关闭
红色的蛋白可以替换,可以将多种不同的开关一起用,成彩像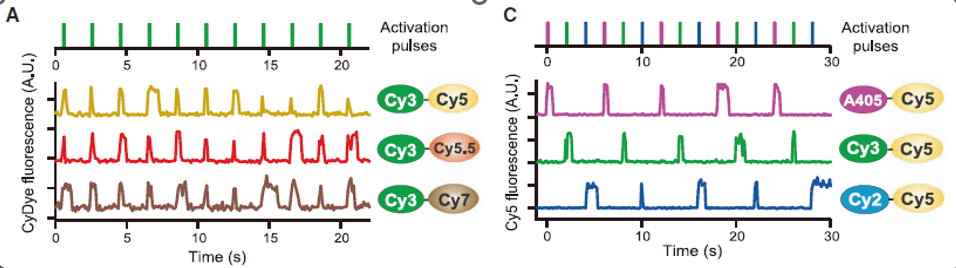
逻辑是:
绿光,强制持续打开;强红,关闭信号
弱红,若开关打开则发光
优点:
荧光开关速度快,比PLAM快
每个荧光分子可以反复开关,可以多次成像
短时间多次尝试测量,受荧光分子随机运动的影响小
缺点:
成像依然不够快,不能做活体实时成像
结构照明显微技术(SIM)
利用摩尔效应
若样品的空间频率为k,结构光的空间频率为k0
在其照射下会产生\(k_{min}=k-k_0到k_{max}=k+k_0\)的摩尔纹
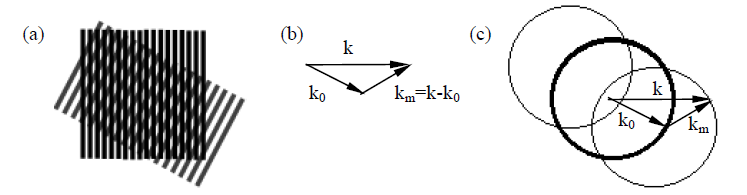
c中粗线为光学系统的分辨率极限,使用一个k0的结构光相当于将这个圆进行平移
最后得到的包络是SIM的分辨率极限
由于k0,km是知道的,可以通过\(\vec{k}=\vec{k_m}+\vec{k_0}\)得到原始图像信息
相当于结构光将成像系统的分辨率极限由km扩展到km+k0
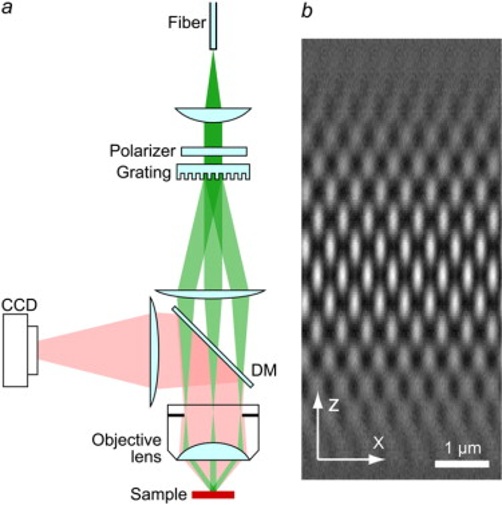
a图中上面用于产生结构光,用CCD记录
对记录的到原始信息进行FFT,对频域信号进行配准和融合(减去k0),得到的频谱做iFFT,得到时域信号
成像时间很短
总结
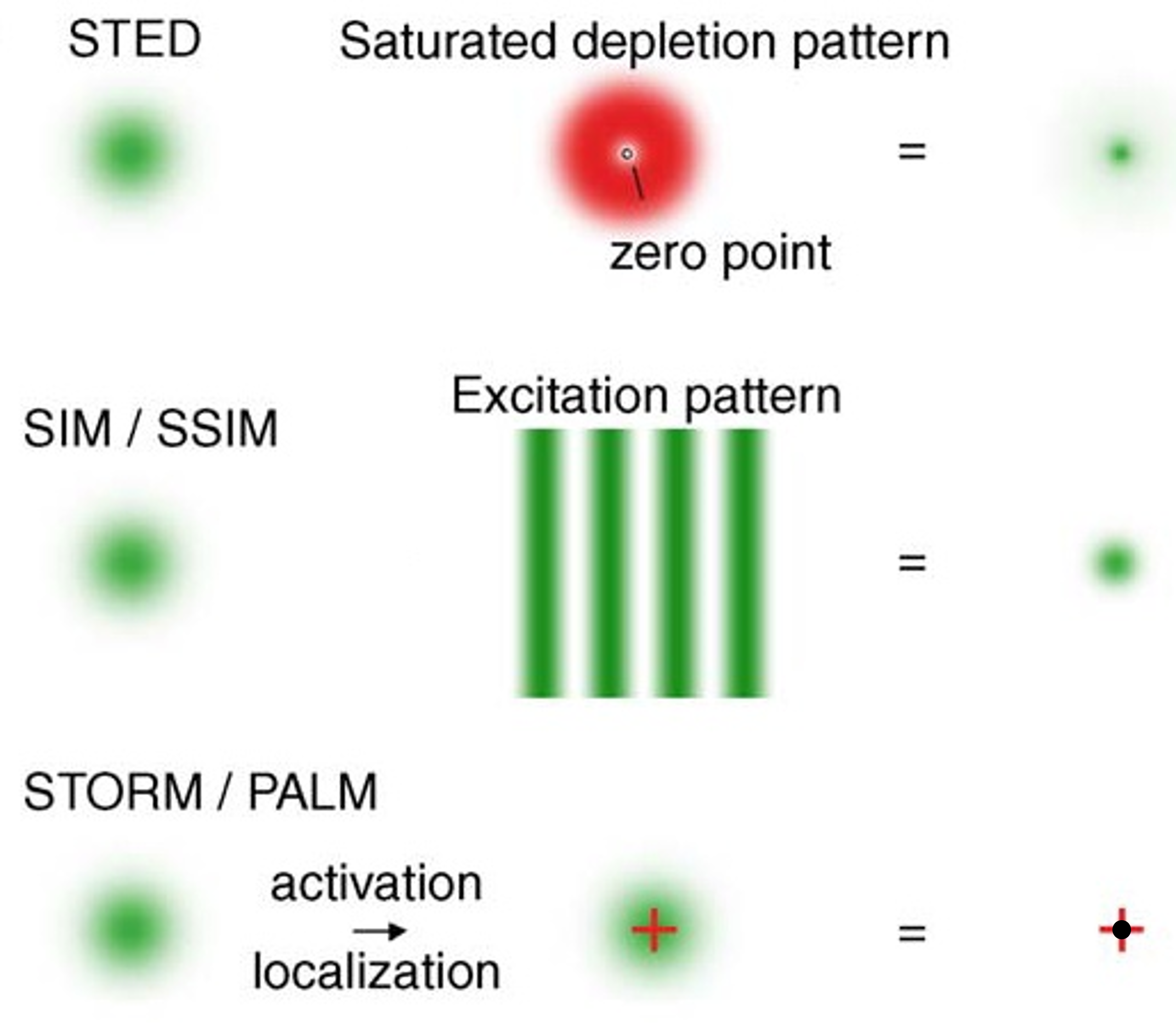
STED最终的绿光周围还有一圈红光,不过会被滤波器过滤
STORM是activation,PALM是localization

- PLAM/STORM图像采集慢
- STED光路复杂,贵,对稳定性要求高
- SIM分辨率提高有限